Quanto maior for o valor de KC maior será a concentração dos produtos?
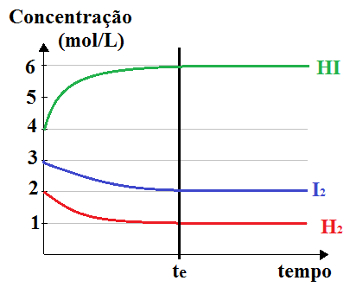
Quando KC 1 Interpreta-se que a concentração dos produtos é maior que a dos reagentes
Se Kc > 1: o valor de Kc será maior do que 1 quando a concentração dos produtos for maior do que a dos reagentes, o que significa que a reação direta prevalece sobre a inversa. Em outras palavras, quanto maior for o valor de Kc, maior será a extensão da ocorrência da reação direta.
Quanto maior o valor da constante de equilíbrio
Constantes de equilíbrio Logo, quanto maior for o valor da constante K$$$_c$$$ , maior será o rendimento da reação, ou seja, haverá o favorecimento na formação de produtos e a concentração destes presentes no sistema será maior que a concentração dos reagentes.
O que diz a constante da concentração KC
A interpretação do Kc é muito simples, pois, quando: Kc = 1, o sistema reacional está em equilíbrio; Kc > 1, o sistema não está em equilíbrio e a reação direta está predominando; Kc < 1, o sistema não está em equilíbrio e a reação inversa está predominando.
Quando a constante de equilíbrio KC for maior que 1
* Kc > 1: significa que os produtos estão em maior concentração, pois, na expressão de Kc, os produtos estão no numerador.
O que altera o KC
Influência da temperatura É a única alteração que pode modificar o valor da KC. O aumento da temperatura beneficia a reação endotérmica. A diminuição da temperatura beneficia a reação exotérmica.
O que acontece com a constante KC se retirarmos uma determinada quantidade de produtos de uma reação em equilíbrio
Com isso, a razão entre as concentrações dos produtos e reagentes se manterá constante, ou seja, o valor da constante de equilíbrio Kc permancerá o mesmo. Isso também ocorrerá para os demais casos, isto é, nenhuma variação na concentração dos reagentes ou dos produtos alterará o valor de Kc.
